열역학 제2법칙을 설명하면서 열기관 효율은 아래와 같다고 하였습니다.
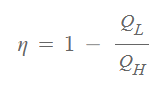
사이클의 열전달 비율인 QL / QH 는 저온부 또는 고온부 환경의 온도만의 함수 입니다. 따라서 아래와 같이 다시 표현할 수 있습니다.

한편 아래와 같이 A, B 사이클의 예를 들어 보겠습니다.

대표사진 삭제
사진 설명을 입력하세요.
가역과정(reversible, 돌이킬 수 있는)으로 Case 1 사이클은 상태1 -> 상태2 -> 상태1로써 A-C 경로 이고 Case2는 상태1 -> 상태2 -> 상태1로써 B-C 경로 변화 입니다.
Case1의 열이동과 온도변화는 위의 공식을 참고로 아래와 같이 표현가능합니다.

Case2는 같은 방식으로 아래와 같습니다.
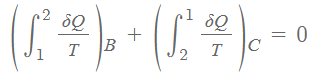
Case1과 Case2의 사이클은 결과적으로 같은 결과를 가지게 되므로 두 식을 합쳐서 아래와 같이 표현할 수 있습니다.
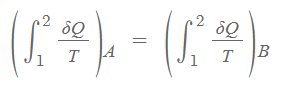
위 식의 변화량은 물성치로써 엔트로피라고 정의하고 S로 표시하며 아래와 같이 다시 표현할 수 있습니다.

엔트로피는 열기관이나 냉동기 사이클의 열출입 발생 시 이를 설명하는 데 사용하고 있습니다.
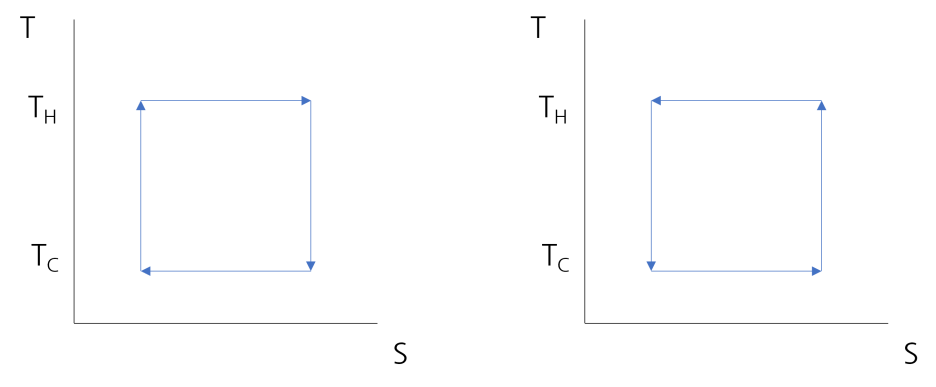
그래프의 수직 좌표는 온도 T 이고 수평 좌표는 엔트로피 S를 나타냅니다. 좌측이 열기관 사이클이고 우측의 그래프는 냉동사이클입니다.
이상으로 엔트로피의 개념을 설명 드렸습니다.
댓글 남기기