열역학 제2법칙은 간단하게 말하면 다음과 같습니다.
1) 자연현상에서 에너지는 높은 곳에서 낮은 곳으로 한 방향으로 흐르며 역방향으로는 움직이지 않는다.
2) 효율이 100%인 열기관은 없다.

위 사진은 우리가 일상생활에서 볼 수 있는 광경입니다. 뜨거운 커피는 주변 공기의 온도보다 높아서 김이 나고 있는데 시간이 지나면 주변 온도와 같아지겠지요. 이렇게 식은 커피는 저절로 다시 뜨거워 질 수가 없습니다. 두번째 사진은 호스에 구멍이 뚫려 물이 새고 있는데 호스밖으로 새어나간 물은 다시 호스안으로 스스로 돌아올 수가 없습니다. 세번째 사진은 폭포인데 아래로 떨어진 물이 저절로 다시 올라갈 수는 없습니다.
열역학 제1법칙인 에너지 보존의 법칙 관점에서 봤을 때 커피의 내부에너지는 감소하지만 주변 공기의 내부에너지는 증가하는 에너지의 이동이 생기기는 하지만 에너지가 소멸되거나 생성되지는 않습니다.
하지만, 기계장치를 이용하면 다시 원래의 상태로 만드는 것이 가능합니다. 히터, 펌프 등을 이용하여 온도를 올리거나 물을 끌어올리는 과정을 만들 수 있습니다.
열역학 제1법칙으로 에너지 보존에 대한 설명이 가능하지만 평형을 이룬 후의 상태를 설명할 수는 없습니다. 커피가 식어 온도가 평형을 이루거나 호스의 물이 빠져 압력이 줄어든 상태, 철에 녹이 생긴 상태, 얼음이 녹은 상태, 화학물질의 혼합에 의한 반응 등 에너지는 형태가 변하거나 이동하여 변화가 없지만 변경된 상태를 열역학 제1법칙으로는 설명할 수 없습니다. 그래서, 이것을 정립한 것이 열역학 제2법칙입니다.
그런데 위의 자연현상에서 평형상태로 변화할 때 에너지를 이용하면 일을 할 수도 있습니다. 예를 들면 폭포에서 떨어지는 물의 위치에너지를 이용하여 터빈을 돌리면 전기를 발생 시킬수가 있겠죠. 여기서 의문이 발생합니다. 그러면 이러한 에너지는 얼마나 일로 변환할 수가 있고 효율이 얼마나 나올까? 이 질문에 답하기 위해 아래와 같이 열역학 제2법칙이 적용됩니다.
1) 프로세스의 방향을 예측하고 2) 평형상태를 수립하고 3) 이론적인 성능을 결정하며 4) 이론적으로 최적 성능을 방해하는 요인은 무엇인지 평가하는데 이용합니다.
열역학 제2법칙의 효용
열역학 제2법칙에 대해 말한 두가지 서술이 있습니다. 클라시우스 서술과 켈빈프랑크 서술 입니다.
클라시우스 서술은 열은 낮은 곳에서 높은 곳으로 저절로 이동할 수 없다는 것입니다. 여기서 저절로라는 말이 중요합니다. 냉동시스템이 낮은 곳의 열을 높은 곳으로 버리는 원리이기 때문입니다. 그래서, 이 말은 일의 투입없이는 냉동시스템이 운전될 수 없다는 의미 입니다.
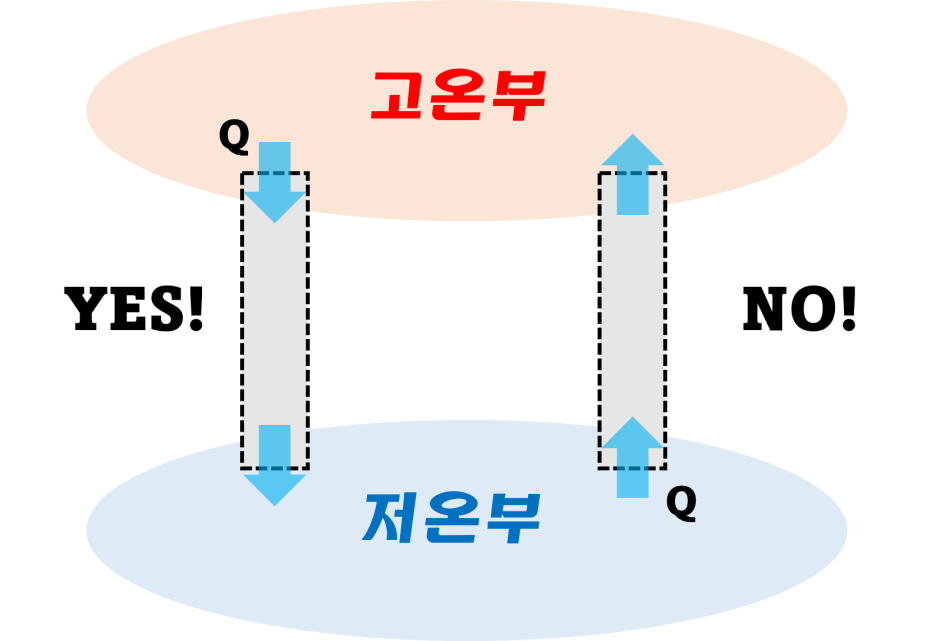
클라시우스의 서술
클라시우스의 서술은 비가역성(irrversible, 돌이킬 수 없는)을 말하는 데 자연계에서 비가역성 과정은 아래와 같습니다.
클라시우스의 서술
1) 온도차에 의한 열의 이동
2) 가스나 액체가 낮은 압력으로 팽창 확산
3) 자발적인 화학 반응
4) 두 개의 다른 물질이 섞임
5) 유체의 흐름 과정에서 마찰 발생
6) 전류가 저항을 통해 흐르는 과정
7) 비탄성 물질의 변형
켈빈프랑크 서술은 고온부(고온환경) 또는 저온부(저온환경) 한 곳에서 열이 이동하여 일로 변환되는 것은 불가능하다는 것입니다. 다시 말하면 열이 전부 다 일로 변하지는 않는 다는 것이고 효율이 100%일 수 없다는 의미입니다.

캘빈프랑크의 서술
열이 고온부에서 저온부로 이동할 때 시스템은 외부환경에 일을 하게 됩니다.
캘빈프랑크의 서술
열역학 제1법칙에 따르면 시스템에서 한 일과 투입된 열의 에너지 양이 같으므로 아래와 같은 공식이 성립합니다.
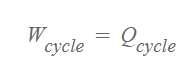
위 식을 열역학 제 2법칙으로 보완하여 표현하자면 아래와 같습니다.
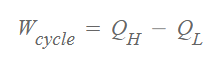
이 열기관의 효율은 아래와 같습니다.

만일 시스템에서 저온부로 열이동 Q L 이 0 이라고 하면 효율은 1 이므로 100%가 되며 이는 캘빈플랑크의 서술에 위배됩니다. 다시말하면 자연계의 모든 열기관은 효율이 100%보다 작습니다.
이상으로 열역학 제 2법칙에 대해 말씀드렸습니다.
댓글 남기기